[TOC]
本笔记内容或有错误,仅供参考
本文 All Right Reserved 保留所有权利,禁止商用和任何形式的转载!
Chemical Bonds 化学键
Chemical Bonds is Attraction ## Metallic Bonds 金属键
金属有很多的自由电子,我们称之为 Mobile Electrons or Delocalized Electron (Sea of Electrons)
金属键就是金属阳离子与这些自由电子之间的吸引力(Attraction)
这些自由电子也很好的解释了为什么 金属是电和热的良好导体
Properties of Metals 金属的性质
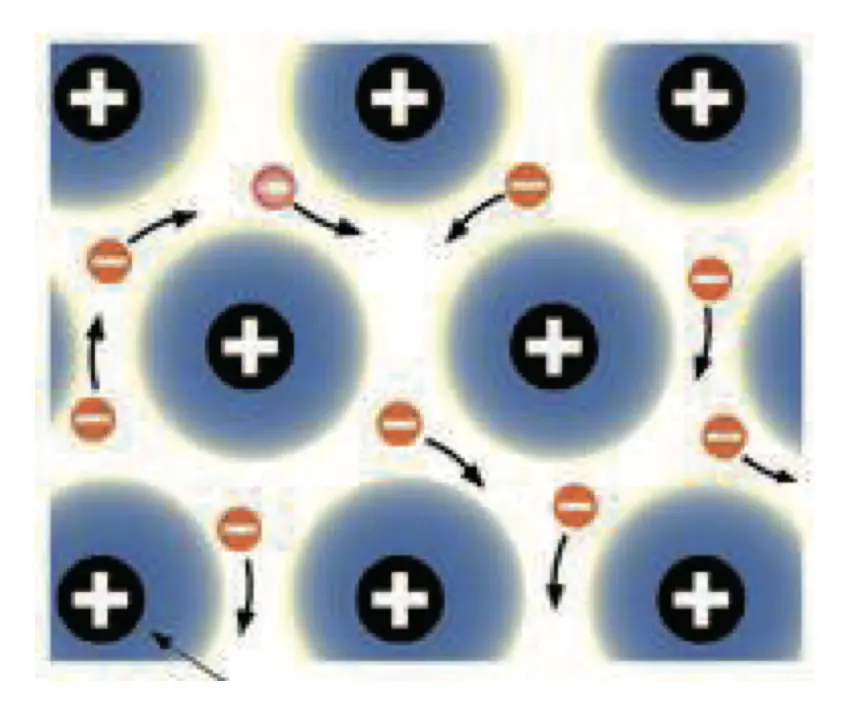
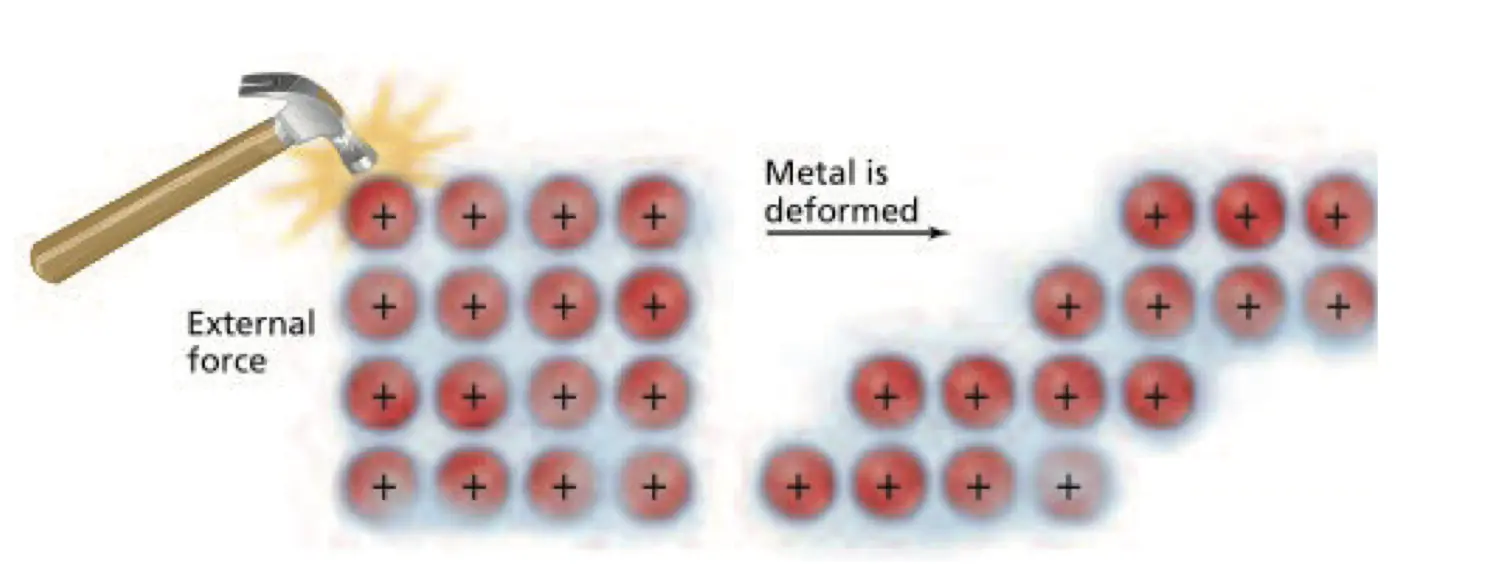
- 金属的延展性很好(Malleable and Ductile),层与层之间可以轻易滑动
- 这是因为形成金属键电子海中的电子是可移动的离域电子(Delocalized Electrons),这些离域电子可以在整个巨大的金属晶格中自由移动,所以当一层金属离子在另一层上滑动时,电子也可以移动,使整个结构粘合在一起。
- 随着金属键的强度增加,金属的融沸点就会增加。
- 金属键的强度由以下两点决定
- 原子半径
- 自由电子的强度
- 而由于自由电子强度受影响的因素太多,故我们只考虑第一主族金属键强度的变化,也就是随着原子半径增加,金属键强度减少(吸引力减少)
- 例如:\(\ce{Na}\) 熔点 \(\pu{882.9 ^\circ C}\),\(\ce{K}\) 熔点 \(\pu{774 ^\circ C}\)
Alloy
- 填隙式合金(Interstitial Alloy),原子半径差异大
- 硬,降低延展性
- 取代式合金 (Substitutional Alloy),原子半径差异小
- 因为破坏了晶格结构,相对纯金属延展性降低,但是相对填隙式合金更好

- AP 2014:
B
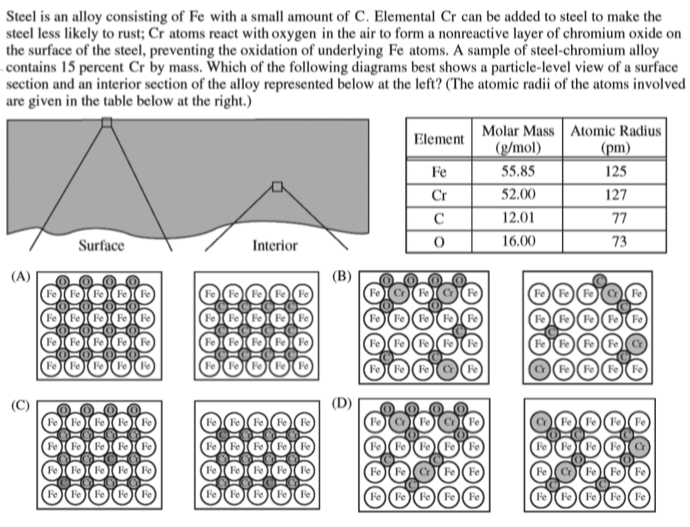
- \(R_\ce{Cr} \thickapprox
R_\ce{Fe}\) 所以排除
A,C,再根据题意,右图应为金属内部图,而题意指出铬是为了防止金属氧化,所以内部不应有 \(\ce{O}\),故选B
Ionic Bonds 离子键
- 一般形成与金属与非金属之间,离子键的本质是正负离子的吸引,形成的原因是电子的转移
\[ \ce{Na+[Cl-]} \]
\(\ce{NH+4Cl-}\) 便是非金属与非金属之间的离子键
离子化合物固态不导电,熔融态(液态)可导电
- 这是因为熔融态离子化合物中的离子才能自由移动
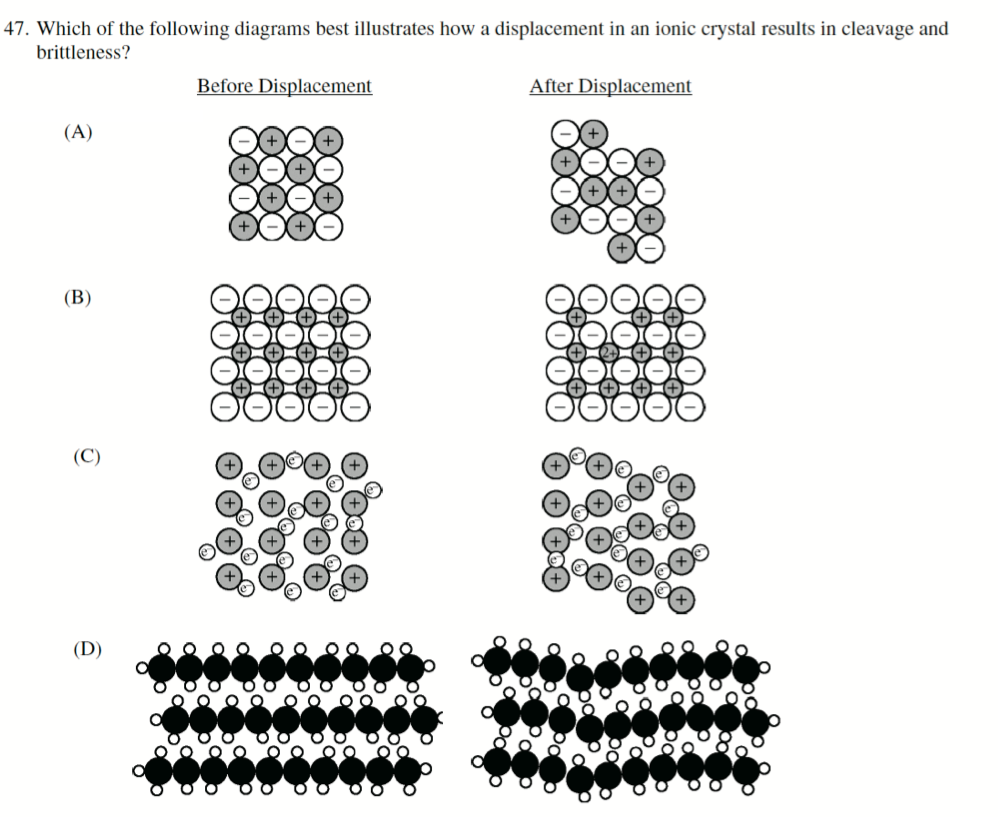
一般而言,离子化合物相对较硬且有更高的熔沸点,并且因为正负电子的排斥效应,会使得离子化合物相对更脆
Practice:
A
Lattice Energy 晶格能
晶格能(Lattice energy),将阴阳离子分开的所需的能量即为晶格能
因为发生相变需要破坏离子键和晶格结构,也就是说,离子键越强化合物熔沸点越高
而离子键的强度大部分受到库仑定律的影响
\[ F = \frac{q_1 q_2 \; \text{(Charge Magnitude)}}{r \; \text{(Distance between Ions)}} \]
- Practice:
B
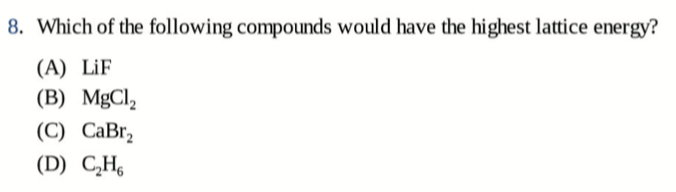
- Practice:
A

Covalent Bonds 共价键
- 共价键,Covalent Bonds,两个原子共用电子,即为共价键
- 与离子键的区别在于,离子键发生了电子的转移,而共价键是共享电子
Polarity of Covalent Bonds 共价键的极性
- 非极性共价键(Nonpolar Covalent Bonds),即共用电子的两个原子获得电子的能力(电负性)基本一致,e.g. \(\ce{Cl_2}\)
- 极性共价键(Polar Covalent Bonds),即共用电子的两个原子获得电子的能力(电负性)差异较大,e.g. \(\ce{HCl}\)
- 参阅 Electronnegativity 电负性
\[ \ce{H(\delta^+) Cl(\delta^-)} \]
分子内都是极性键,不一定分子就是极性分子,e.g. \(\ce{CO2, CCl_4}\),分子极性主要取决于空间构型
偶极矩(Dipole Moment)是正、负电荷中心间的距离和电荷中心所带电量的乘积,它是一个矢量,方向规定为从正电中心指向负电中心
\[ \mu = \delta \vec{d} \]
- Practice:
A
Bond Length and Bond Energy 键长与键能
键长(Bond Length),即为两个原子半径之和
键能(Bond Energy),即为破坏这根键所需要的能量
一般而言,键能符合如下规律
\[ \begin{aligned} \ce{H&-H} \; \text{(Small)} \\ \ce{O&\bond{2}O} \\ \ce{N&\bond{3}N} \; \text{(Big)} \end{aligned} \]
- 键长则符合如下规律
\[ \begin{aligned} \ce{C&-C} \; \text{(Small)} \\ \ce{C&\bond{2}C} \\ \ce{C&\bond{3}C} \; \text{(Long)} \end{aligned} \]
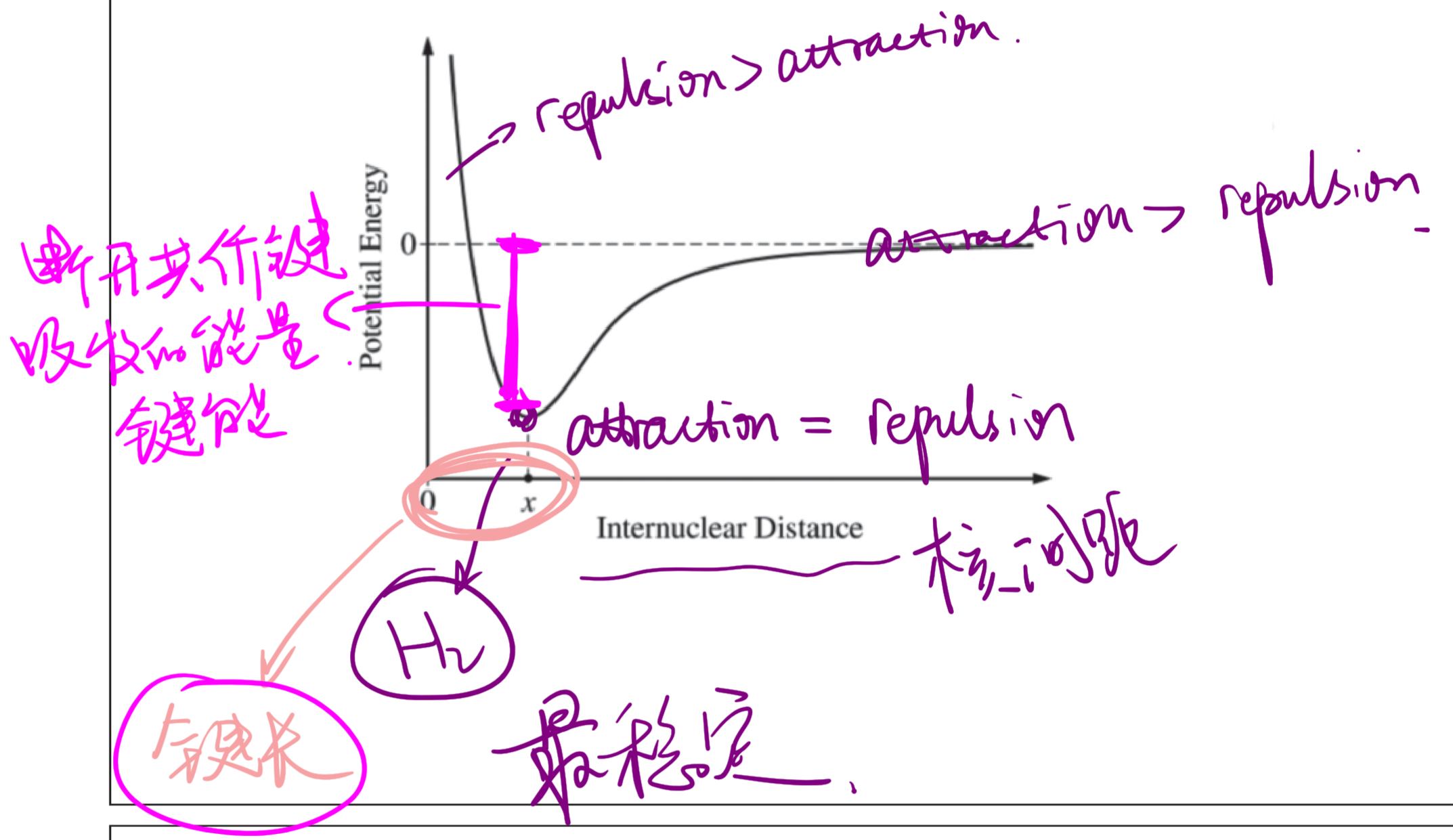
Formation of Covalent Bonds 共价键的形成
- 在图示最低点,纵座标与上方势能零点的差值为键能,横座标为键长
- Practice:
A

- AP 2014:
A
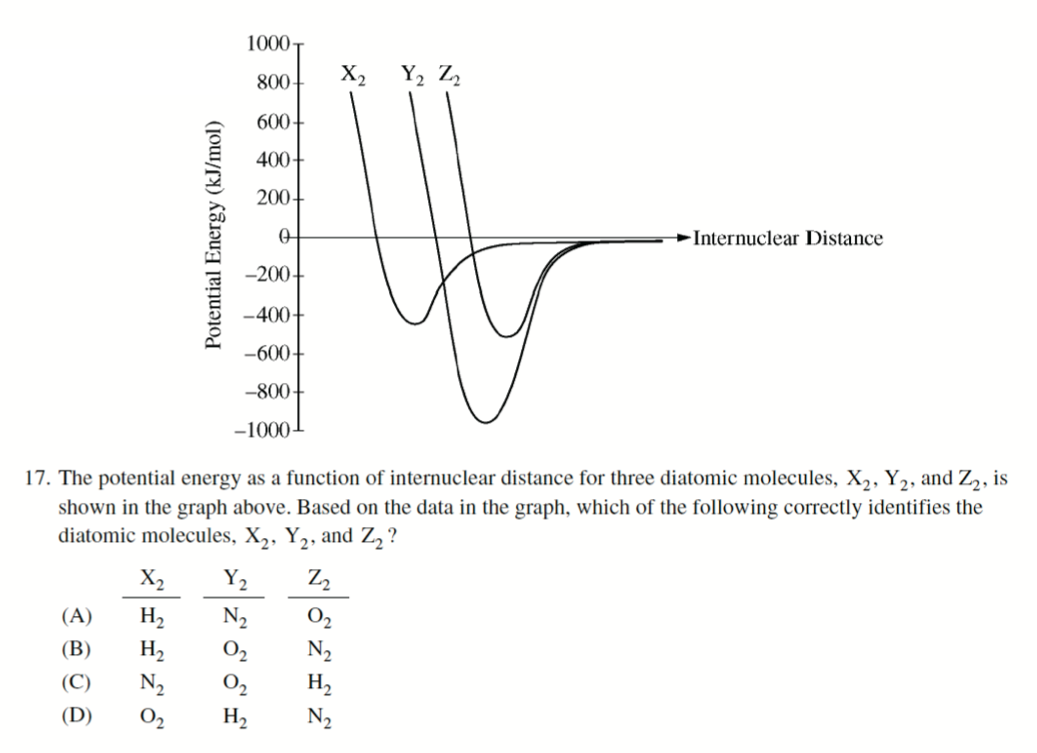
- \(\ce{H-H}, \ce{N\bond{3}N}, \ce{O\bond{2}O}\)
- 注意此题不能比较键长,键长只能同类比较
Lewis Structure Diagram 路易斯结构图
- 路易斯结构图(Lewis Structure Diagram),展现的是最外层电子的排布,一般情况下需要符合八隅体规则(Octet Rule)
- 成键电子对(Bonding Pair)
- 孤对电子(Lone Pair)
How to Draw Lewis Structure Diagram 如何画路易斯结构图
- 一般的,我们认为第七主族的元素倾向于形成一根共价键,第六主族元素倾向于形成两根,以此类推
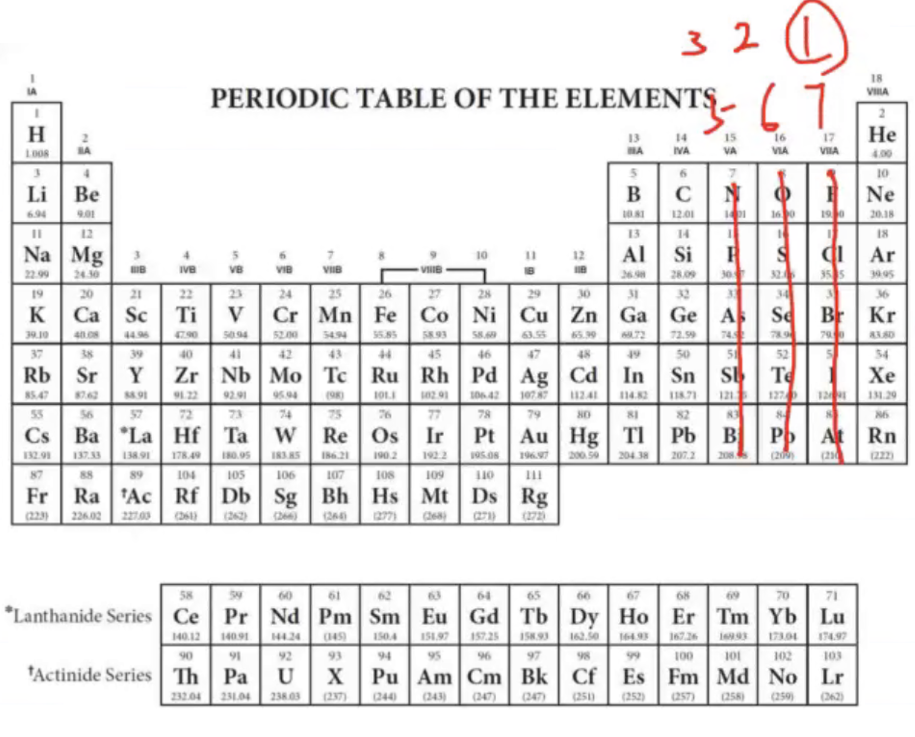
- 对于更一般的情况,我们遵循以下步骤
- 确定中心原子(有碳选碳,没碳选电负性小的)
- 计算每个原子的价电子数量
- 让周围的原子按顺序尽量满足最外层八电子/二电子
- 当中心原子已经八电子时,考虑使用配位键让剩下的周围原子满足最外层八点子(下一小结的特例除外)
- Practice: \(\ce{H-O-N\bond{2}O}\)

- 注意,不可以是 \(\ce{H-O\bond{2}N-O}\),\(\ce{O}\) 只能伸出两根键
Resonance 共振
- 共振结构意味着有多种路易斯结构画法,如图所示
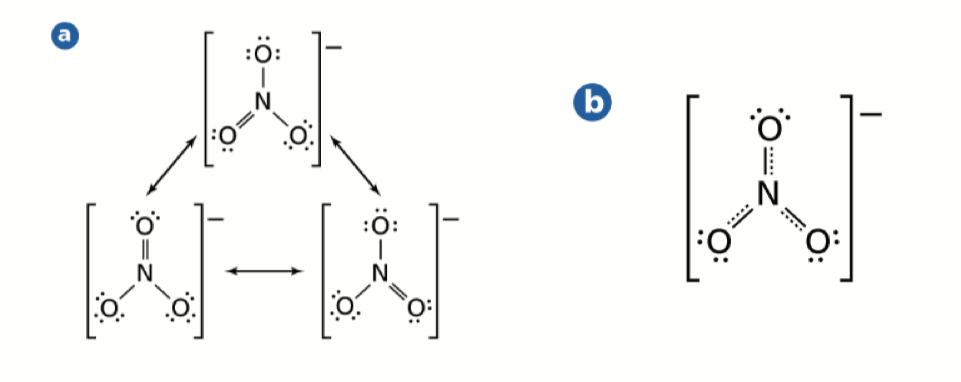
- 但共振的本质是电子在不同地方同时存在,可以认为是一种运动,我们也称这种键为离域 \(\pi\) 键(Delocalized \(\pi\) Bond)(苯环中的圆便是共振结构)
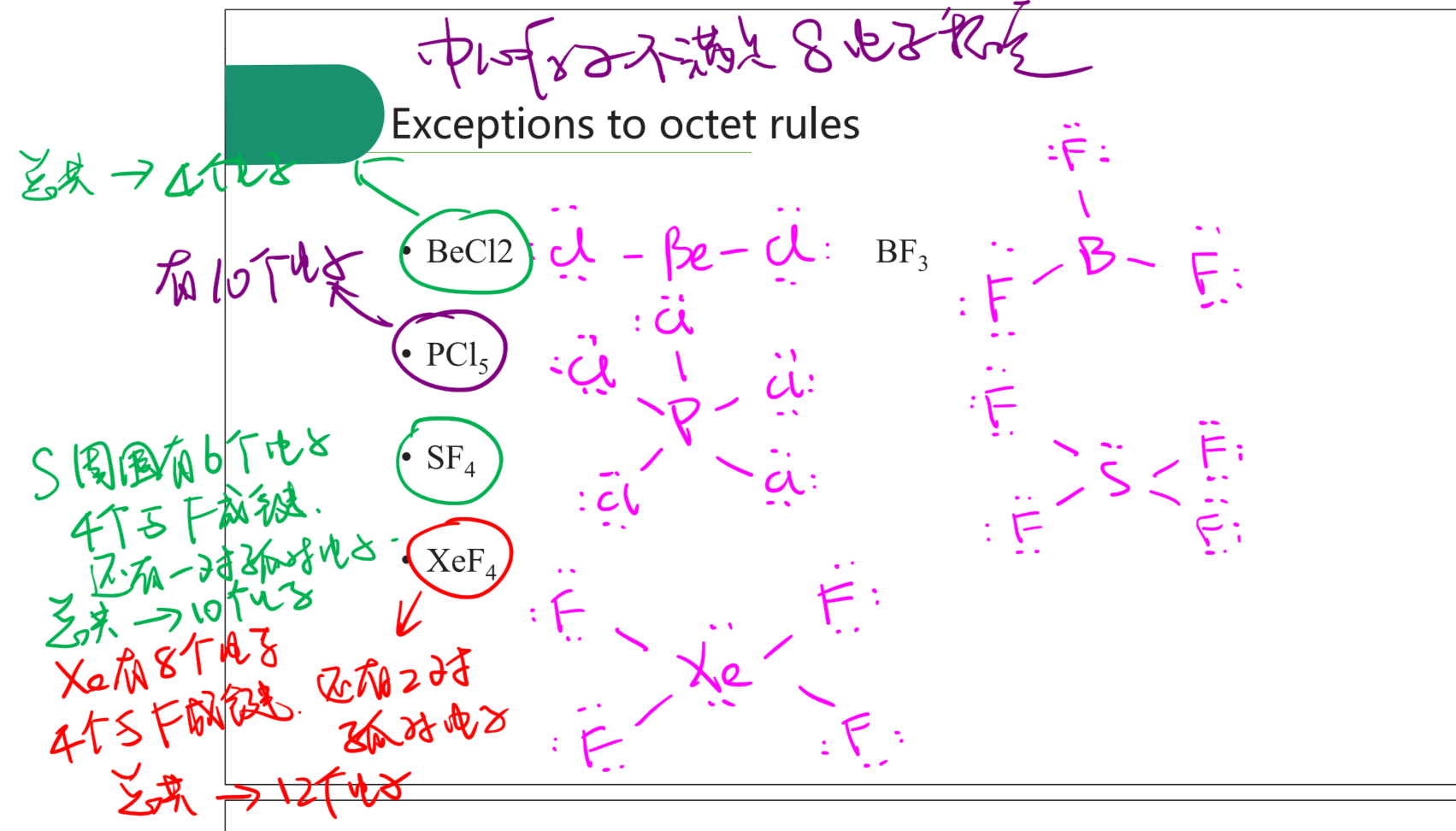
Exception of Lewis 特例
VSEPR Model
价层电子对排斥模型(Valence Shell Electron Pair Repulsion Model)
电子域(Electron Domain),成键域(Bonding Domain),非成键域(Nonbonding Domain)
\(\text{Lone Pair - Lone Pair} > \text{Lone Pair - Bonding Pair} > \text{Bonding Pair - Bonding Pair}\)
| Molecular Type | Electron Geometry | Molecular Geometry | Approximate Bond Angles | Figure | Example |
|---|---|---|---|---|---|
| \(\ce{AX2E_n}\) | Linear | Linear | \(180^\circ\) |  | \(\ce{O_2}\) |
| \(\ce{AX2E0}\) | Linear | Linear | \(180^\circ\) |  | \(\ce{BeCl2, HgCl2, CO2}\) |
| \(\ce{AX3E0}\) | Trigonal Plannar | Trigonal Plannar | \(120^\circ\) | 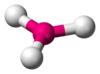 | \(\ce{BF3, CO3^2-, NO3^-, SO3}\) |
| \(\ce{AX2E1}\) | Bent | \(109.5^\circ\) | 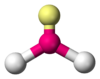 | \(\ce{NO2^-, SO2, O3}\) | |
| \(\ce{AX4E0}\) | Tetrahedral | \(<109.5^\circ\) | 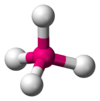 | \(\ce{CH4, PO4^3-, SO4^2-, ClO4^-}\) | |
| \(\ce{AX3E1}\) | Trigonal Pyramidal | \(<109.5^\circ\) |  | \(\ce{NH3, PCl3}\) | |
| \(\ce{AX2E2}\) | Bent | \(<<109.5^\circ\) | 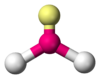 | \(\ce{H2O, OF2}\) | |
| \(\ce{AX5E0}\) | Trigonal Bipyramidal | Trigonal Bipyramidal | \(120^\circ\), \(90^\circ\) | 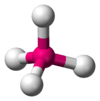 | \(\ce{PCl5}\) |
| \(\ce{AX4E1}\) | Seesaw | \(<120^\circ\), \(<90^\circ\) |  | \(\ce{SF4}\) | |
| \(\ce{AX3E2}\) | T-shaped | \(<90^\circ\) | 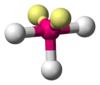 | \(\ce{ClF3, BrF3}\) | |
| \(\ce{AX2E3}\) | Linear | \(180^\circ\) | 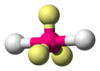 | \(\ce{XeF2, I3^-}\) | |
| \(\ce{AX6E0}\) | Octahedral | Octahedral | \(90^\circ\) | 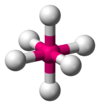 | \(\ce{SF6}\) |
| \(\ce{AX5E1}\) | Square Pyramidal | \(<90^\circ\) | 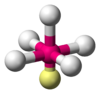 | \(\ce{ClF5, BrF5}\) | |
| \(\ce{AX4E2}\) | Square Planar | \(90^\circ\) | 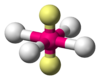 | \(\ce{XeF4}\) |
Molecular Polarity 分子极性
- 当没有 Lone Pair,且周围原子都是一样时认为所有的力可以被相互抵消(cancel out),除了 \(\ce{AX_2E_3} ,\; \ce{AX_4E_2}\)
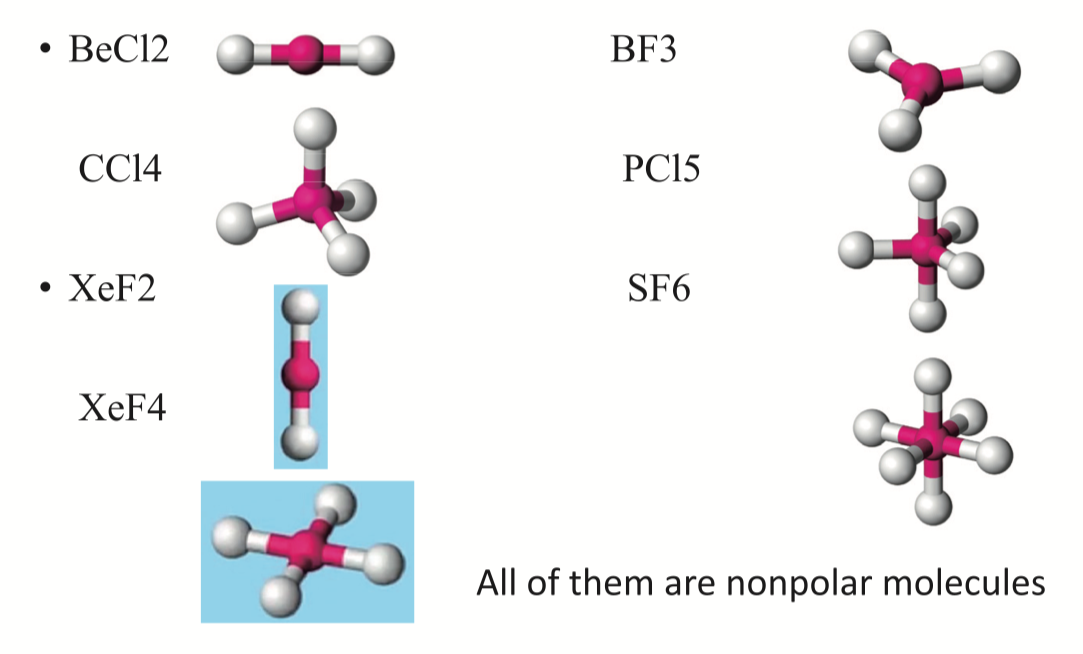
在 FRQ 中,应回答 “The \(\ce{XXX}\) molecule is nonpolar because all of the bond dipoles in the molecule have been cancelled out.”
Practice:
D

- \(\ce{BF3}\) 的构型为 \(\ce{AX3}\), 无 Lone Pair 所以是 Nonpolar,但是 \(\ce{NF3}\) 的构型为 \(AX3E1\),有 Lone Pair 且不是 \(\ce{AX_2E_3} ,\; \ce{AX_4E_2}\),可以在平面上抵消,所以是 Polar
Hybridization 杂化
为什么会有杂化理论?让我们以 \(\ce{CH4}\) 为例,不难画出 \(\ce{CH4}\) 的结构图和电子排布式 \(\ce{1s^2 2s^2 2p^2}\),这便产生了问题
在 \(\ce{CH4}\) 的结构图上,我们认为 \(\ce{C}\) 对四个 \(\ce{H}\) 形成的共价键是等价的,这需要 \(\ce{C}\) 外层的 4 个电子 \(\ce{2s^2 2p^2}\),但同时显然这两个不同轨道上的电子形成的键不会相同,所以杂化理论孕育而生用于解释这种现象。
杂化理论的示意图如下所示
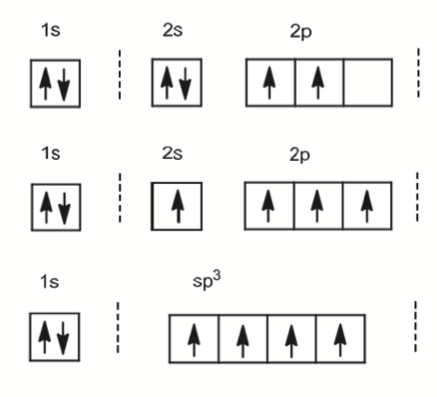
最上方为 \(\ce{C}\) 的初始轨道排布,在杂化过程中首先会将 \(\ce{2s^2}\) 中的电子转移一个到 \(\ce{2p}\) 轨道上形成 \(\ce{2s 2p^3}\),最后合并 $ $两个轨道形成 \(\ce{sp^3}\) 杂化轨道,轨道总数保持相同,这便是 \(\ce{CH4}\) 的 \(\ce{sp^3}\) 杂化。
\(\ce{sp^2 sp}\) 杂化同理,轨道总数保持相同。
对于 AP 考试而言,最简单判断杂化方式的方法便是,\(\text{Electron Domain} - 1\)
Practice: \(\ce{H-O-N\bond{2}O}\) 中 \(\ce{N}\) 的杂化方式是? ── \(3 - 1 = \ce{sp^2}\) 杂化
Practice:
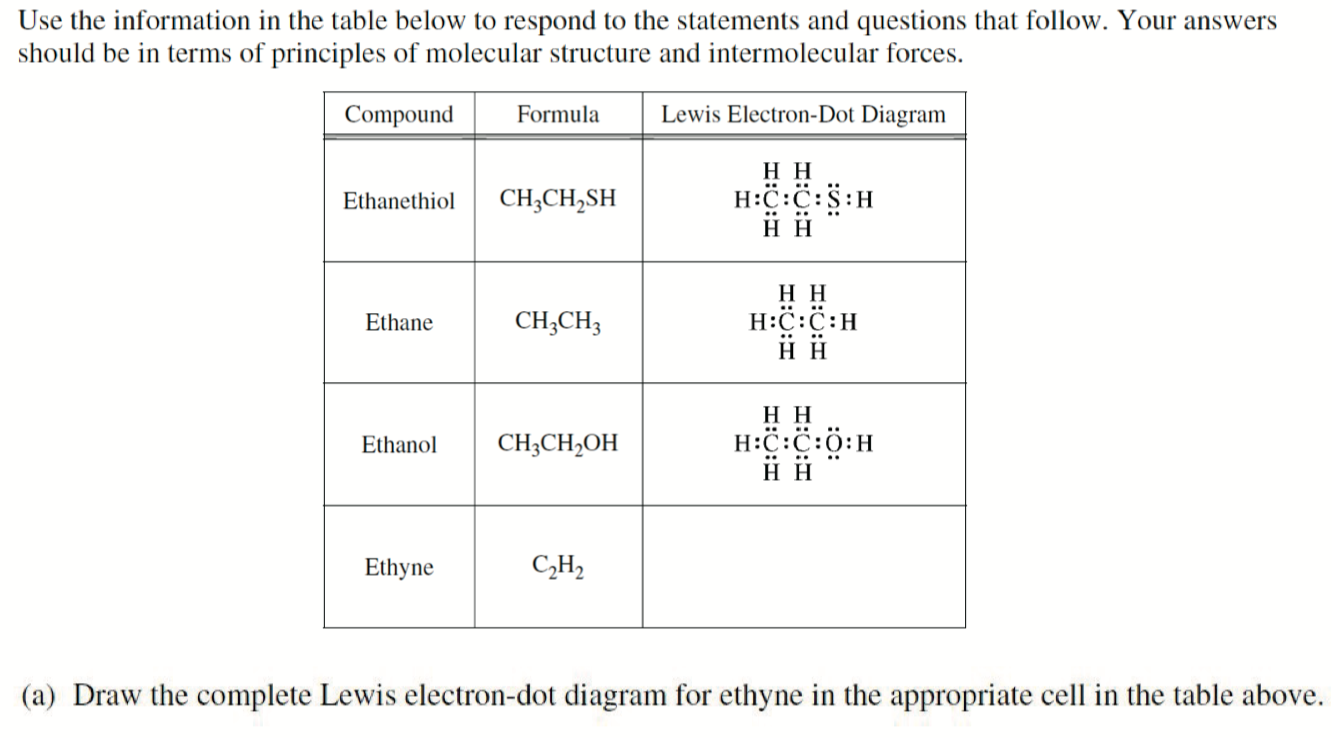
- Draw the complete Lewis electron-dot diagram for ethyne in the appropriate cell in the table above.
\(\ce{H-C\bond{3}C-H}\),首先确定两个 \(\ce{C}\) 为中心,且 \(\ce{C}\) 至少伸出 4 键,而 \(\ce{H}\) 最多 1 键
- Which of the four molecules contains the shortest carbon-to-carbon bond? Explain
同种 \(\ce{C}\) 元素比较键长,三键最短,为 Ethyne
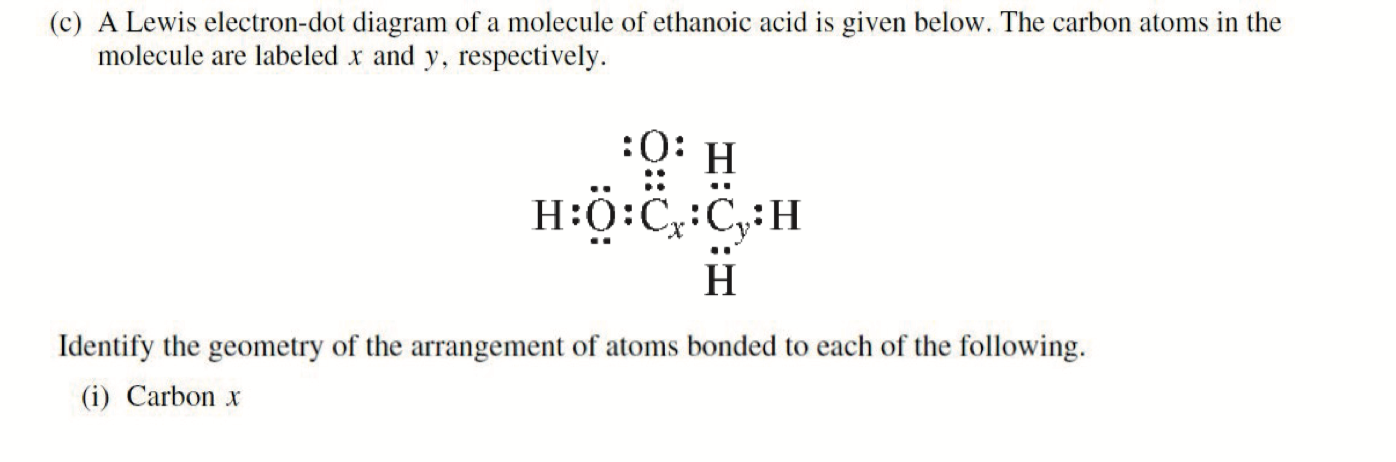
\(\ce{C_x}\) : \(\ce{AX3}\) Trigonal Planar
\(\ce{C_y}\) : \(\ce{AX4}\) Tetrahedral
Bond Order, Resonance and Formal Charge 键级, 共振与形式电荷
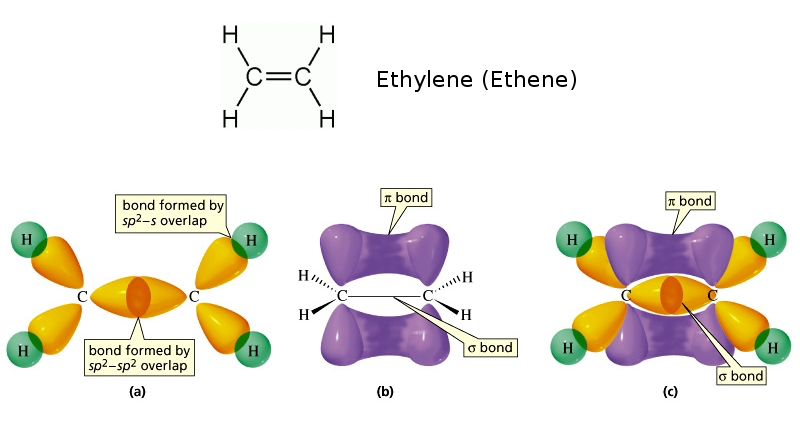
Sigma & Pi Bond
- Sigma \(\sigma\) Bonds: 「头碰头」方式重叠,重叠面积比较大,键比较稳定 Linear Overlap (End-on)
- Pi $$ Bonds: 「肩并肩」方式重叠,重叠面积较小,键不那么稳定 Sideway Overlap
有言道「沿轴头碰头,平行肩并肩」
| Bond Type: | Single | Double | Triple |
|---|---|---|---|
| Bond Designation: | \(\sigma\) | \(\sigma\) and \(\pi\) | \(\sigma\) and \(2\pi\) |
| Bond Order: | 1 | 2 | 2 |
| Bond Length: | Longest | Intermediate | Shortest |
| Bond Energy: | Least | Intermediate | Greatest |
- Bond Order, 键级 在 AP 中可以简单理解为「键的强度」
Resonance and Bond Order 共振与键级
- 对于共振结构的化合物,其共振本质上是电子在不同位置上做运动形成「离域 $$ 键」,可以认为其键的强度和各种性质均为正常键的 \(\frac{m}{n}\),其中 \(m\) 为总键数(固定键 + 可变键),\(n\) 为固定键

- 所以对于上图,\(\ce{[NO3]-}\) 中 \(\ce{N\bond{~-}O}\) 键长,应介于 \(\ce{N\bond{-}O}\) 与 \(\ce{N\bond{2}O}\) 之间
- 其中固定键为 \(3\),可变键为 \(1\),键级为 \(\frac{3+1}{3} = \frac{4}{3}\)
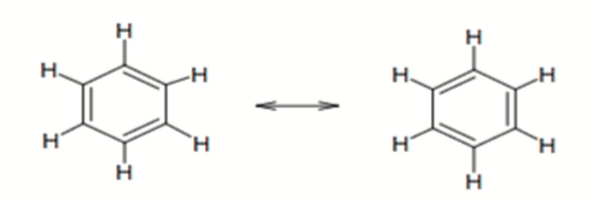
- 苯环 \(\ce{C6H6}\),其中固定键为 \(6\),可变键 \(3\),键级为 \(\frac{6 + 3}{3} = \frac{9}{3} = 1.5\)
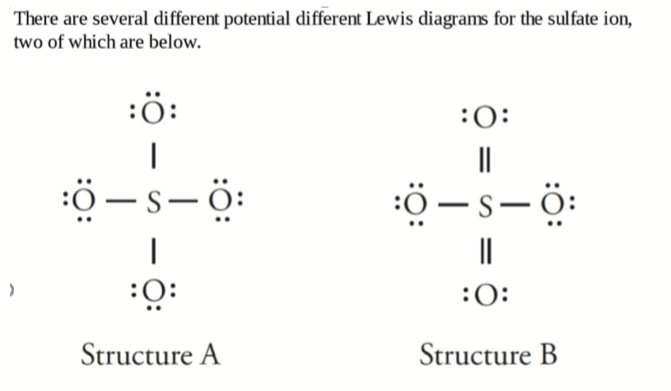
固定键为 \(4\),可变键为 \(2\),键级为 \(\frac{4 + 2}{4} = \frac{6}{4} = 1.5\)
Practice:
D

- 对于共振结构,Lewis 结构式并不全面(甚至可以说是有缺陷的),实际上并没有两根键,而是这 \(2\) 根键在 \(4\) 个不同位置上做运动,所以每根键的键级和强度都是等价的
Formal Charge 形式电荷
\[ \text{Formal Charge} = \text{(Valence Electrons)} - \text{(Unbonded Electrons)} - \text{(Bonds)} \]
- 对于下图,我们可以分别计算 \(\ce{S}, \ce{O}\) 的形式电荷
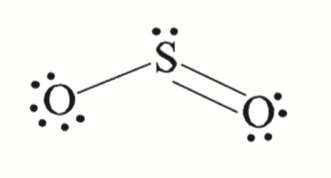
\(\ce{S}\): 本身原有最外层电子为 \(6\),在图中剩下的 Lone Pair 为,\(2\),连了 \(3\) 根键,所以 \(\text{Formal Charge} = 6 - 2 - 3 = 1\)
同理可以算出,\(\text{Left } \ce{O} = 6-6-1 = -1\),\(\text{Right } \ce{O} = 6-4-2 = 0\)
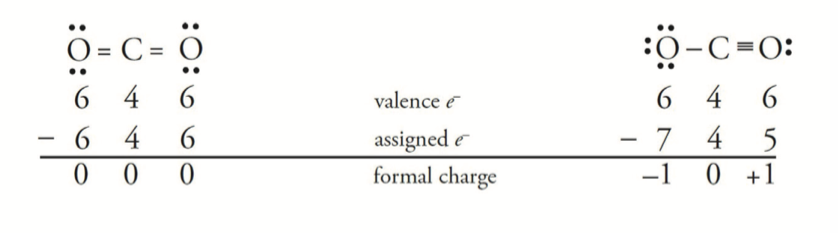
形式电荷为 \(0\) 的时候是该物质最有可能的结构,如下图,更有可能的结构是 左边,而不是右边
这同样解释了为什么 元素周期表法 是绘制路易斯结构式较为有效的方法之一
对于无法计算为 \(0\) 的结构,电负性更高的元素更有可能 Formal Charge 为负数,例如下图所示,我们认为图 3 是一个更有可能的选择
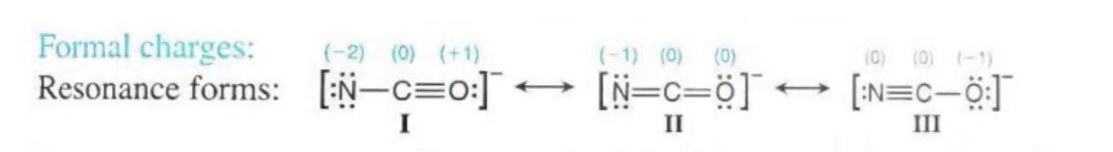
- AP FRQ 2017:

Tips: Formal Charge 可以通过元素周期表法和键的数目快速计算,比如左图中 \(\ce{H}\) 应该伸出 \(1\) 根键,实际伸出 \(1\) 根键,那么 \(H\) 的 Formal Charge 便为 \(0\)。同理,对于 \(\ce{N}\) 而言,应该伸出 \(3\) 根键,实际伸出 \(4\) 根键,那么 \(N\) 的 Formal Charge 便为 \(+1\)。所以我们可以粗略认为,多伸键为正,少伸键为负
- 左边的结构 Formal Charge 依次为 \(\pu{0 0 +1 -1}\),右边为 \(\pu{0 -1 +1 0}\),而负 Formal Charge 一般在电负性高的元素上,所以我们认为,左边的结构更有可能(在实际考试中需写出 Formal Charge 计算过程)
