[TOC]
ABQ 还在学习,笔记仍在更新,内容或有错误,仅供参考
本文 All Right Reserved 保留所有权利,禁止商用和任何形式的转载!
Intermolecular Forces 分子间作用力
注意:Molecule 一般指的是由共价键组成的共价化合物,离子化合物不属于 Molecule,所以 \(\ce{NaCl}\) 不存在分子间作用力
- 对于物质的相变,例如 \(\ce{H2O}\) 我们不需要克服 Intramolecular Forces (Bonds),而需要克服 Intermolecular Forces
- 所以相应的 Intermolecular Forces 更高,那么熔沸点更高
London Dispersion Forces 伦敦色散力
分子有很多电子,电子一直在运动,所以电子云可以产生瞬间偶极,这些偶极间的作用力称为伦敦色散力(London Dispersion Forces)
如下左图,首先第一个阶段,两个分子无极性;接着到第二阶段,左边的分子因为电子的运动瞬间产生了一对偶极矩;到第三阶段,左边的分子产生的瞬时偶极矩会诱导右边的分子同样产生一个瞬时的偶极矩,这便是伦敦色散力的原因


所有分子都存在伦敦色散力,并且色散力大小取决于电子多少和接触点
摩尔质量越大的分子电子越多,电子越多表明分子的可极化性(Polarizability)越强,可极化性越强意味着伦敦色散力越强
AP 2015:
B

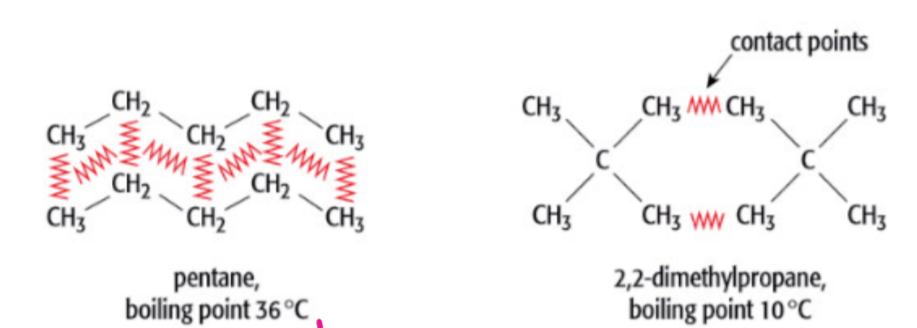
- 接触点同样会影响伦敦色散力,如下图所示:左右两边同为 \(C5H12\),但是左边的熔沸点会高于右边,这是因为左边结构是直链,两个分子之间的接触面更大,而右边的是侧链结构,两个分子的接触面相对更小,所以伦敦色散力会更小
- AP 2013:
C
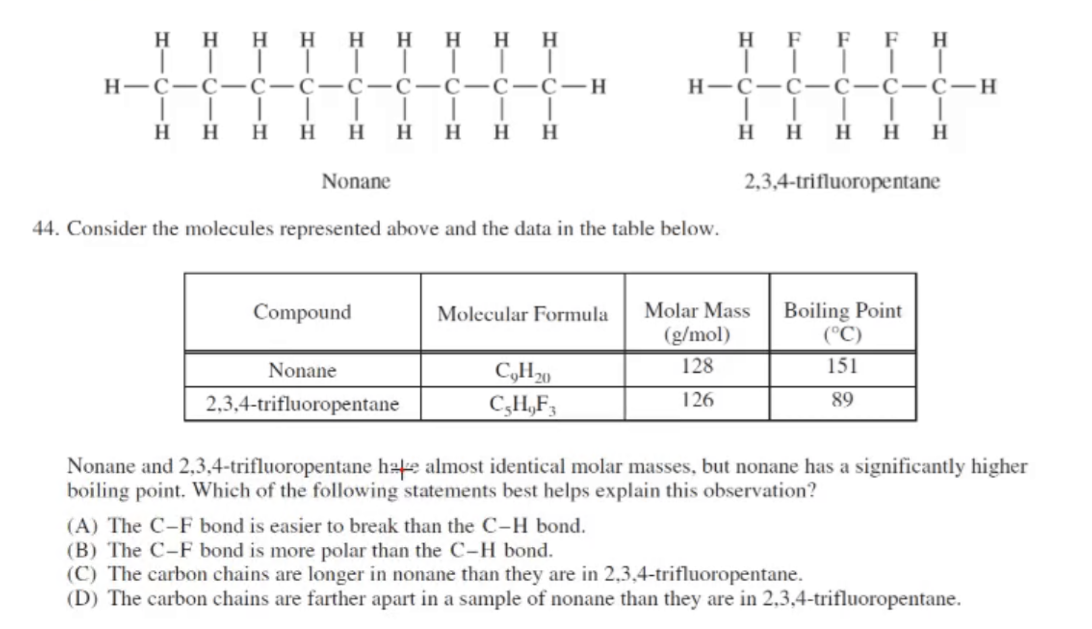
- 左边物质的碳链更长,所以分子间的接触点和接触面相交于右边的更大,所以熔沸点会更高
Dipole-dipole Forces 偶极力
- 极性分子中的永久偶极间的作用力,只有极性分子之间存在这种力
注意:极性分子不是一定就比非极性分子的 Intermolecular Forces 要高,比如 \(\ce{HCl}\) 和 \(\ce{CCl_4}\),即便 \(\ce{HCl}\) 是极性分子同时有 伦敦色散力 和 永久偶极力,但是仍然比不过 \(\ce{CCl_4}\) 的 伦敦色散力
Dipole-induced Dipole Forces 偶极诱导偶极作用力
- 极性分子诱导非极性分子产生偶极,诱导出来的偶极和极性分子的偶极之间的作用力,为偶极诱导偶极作用力
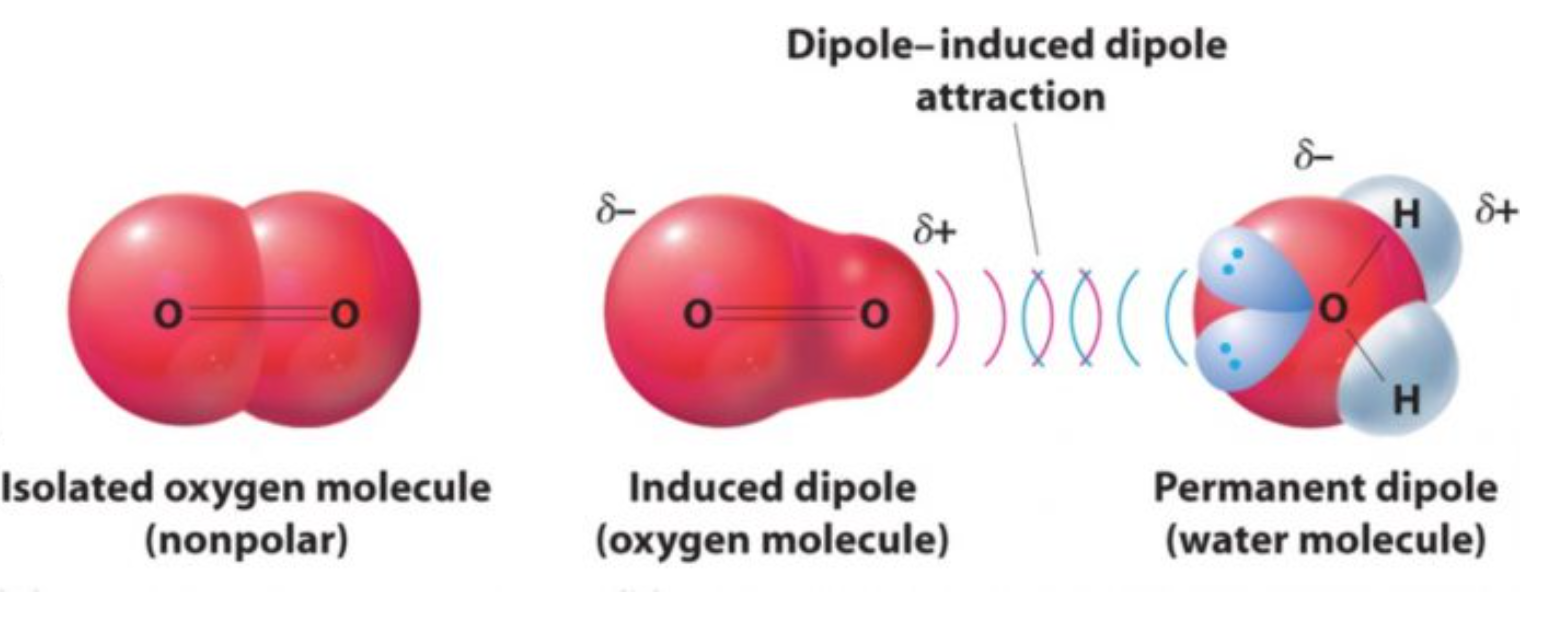
一般来说最常见的情况,就是水解,\(\ce{H2O}\) 是极性的,可以诱导非极性分子产生 Dipole-induced Dipole Forces
Practice:
D
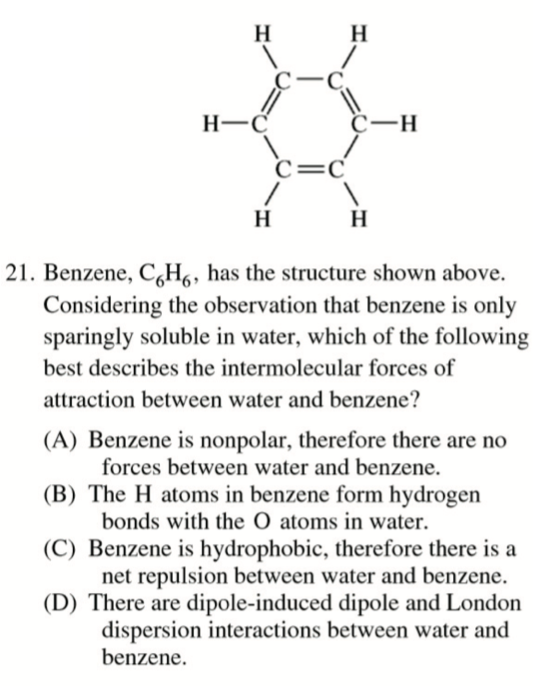
Hydrogen Bonding 氢键
属于 Dipole-diople Forces 作用力的一种,但是很强
在分子内 \(\ce{H}\) 直接连接在 \(\ce{N, O, F}\) 这类电负性大的元素上(因为电负性大会容易形成强偶极),例如 \(\ce{N \bond{1} H \bond{~} N - H}\)
在分子间的部分是 \(\ce{H \bond{~} N / O / F}\),这中间的 \(\ce{\bond{~}}\) 才是氢键,所以形成氢键有两个条件
- 分子内 \(\ce{H}\) 直接连接在 \(\ce{N, O, F}\)(但这是分子内部的共价键)
- 分子间的连接是 \(\ce{H \bond{~} N / O / F}\)
氢键本身是 Intermolecular Forces,但是形成氢键的条件是分子内 \(\ce{H}\) 直接连接在 \(\ce{N, O, F}\) 上,但这个不是氢键,而是共价键
AP 2015:
C
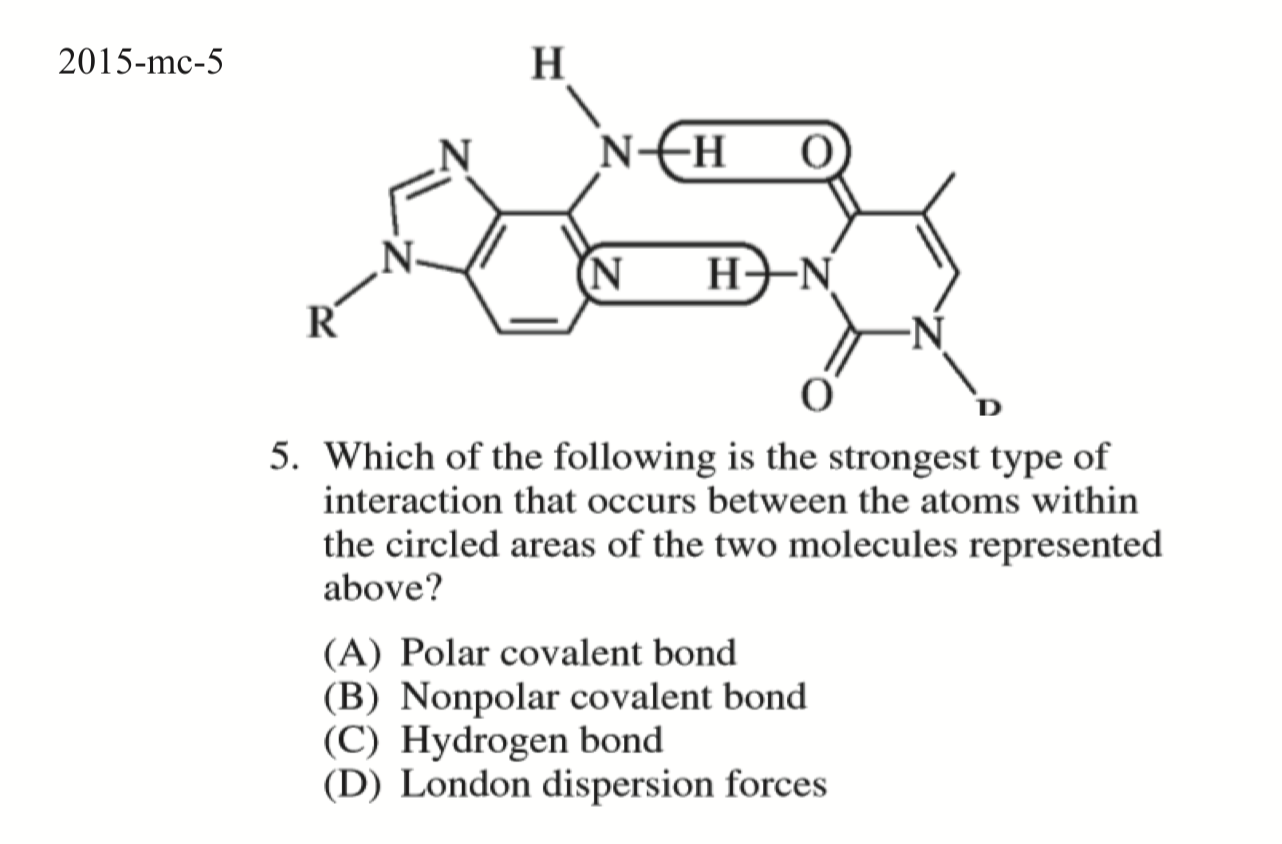
- Practice:
D

- Strength Summary of Intermolecular Forces

- Practice:
B
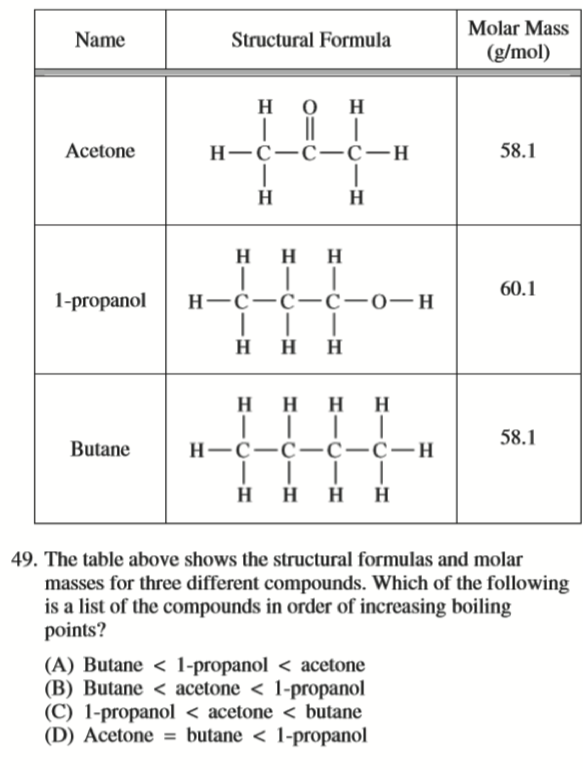
Acetone 存在 London Dispersion Forces 和 Dipole-dipole Forces
1-propanol 存在 Hydrogen Bonding
Butane 只有 London Dispersion Forces
Practice:
B
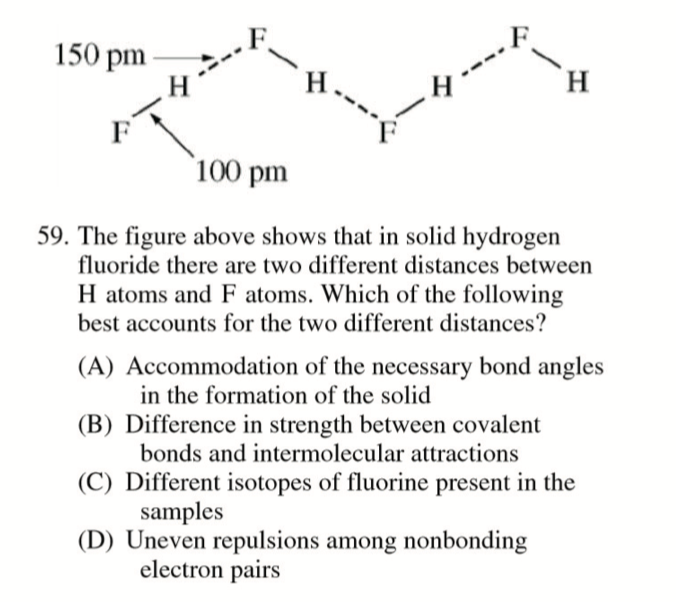
FRQ: Compare the strength of the dipole-dipole forces in liquid \(\ce{H2S}\) to the strength of the dipole-dipole forces in liquid \(\ce{H2O}\). Explain.
- The strength of the dipole-dipole forces in liquid \(\ce{H2S}\) is weaker than that of the dipole-dipole forces in liquid \(\ce{H2O}\). The polarity of the $ $molecule is less than that of the \(\ce{H2O}\) molecule. This results from the lesser polarity of the \(\ce{H\bond{1}S}\) bond compared with that of the \(\ce{H\bond{1}O}\) bond (\(\ce{S}\) is less electronegative than \(\ce{O}\)).
Gas, Liquid, Solid 固液气
Solid 固体
- Network Solid 是指完全由共价键组成的 Giant Molecule (or Macronmolecular Substance),比如钻石
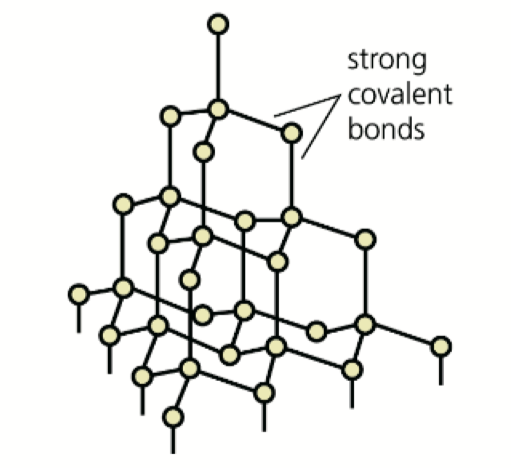
- 因为 Network Solid 是完全由共价键组成,所以熔沸点非常高,\(\ce{SiO2}\) 也是可以是 Network Solid
Allotrope 同素异形体
- 对于同一种元素,比如 \(\ce{C}\),可以同时有钻石,和石墨两种形态,这是因为结构的差异

- 石墨是分层的,所以层和层之间很容易滑动,所以石墨是软的,金刚石是硬的
- 钻石中的 \(\ce{C}\),四个电子都形成了共价键,所以不导电,石墨中 \(\ce{C}\) 只用了 3 个电子形成共价键,所以有很多自由移动的电子
Crystal 晶体
| 晶体类型 | 力 | 例 | 熔沸点 | 硬度 | 导电性 | 熔沸点分析 |
|---|---|---|---|---|---|---|
| Ionic 离子 | 静电吸引力 | \(\ce{LiF, NaCl}\) | 高 | 硬,脆 | 熔融态或溶液态导电性良好 | \(\ce{Na < Mg < Al}\) \(\ce{+1 < +2 < +3}\) 根据金属键强弱 |
| Covalent Network 原子晶体 | 共用电子对(共价键) | \(\ce{Diamond}\) | 非常高 | 非常硬 | 无 | \(\ce{NaCl < MgCl_2 <
Al_2O3}\) 库仑定律分析 |
| Molecular 分子晶体 | 分子间作用力 | \(\ce{H2O, HCl, He}\) | 低 | 软 | 无 | 式量越大 $$ LDF 越大 $$ 熔沸点越高 |
| Metallic 金属晶体 | 电子海与金属阳离子的静电吸引力 | \(\ce{Na, Fe, Cu}\) | 有高有底 | 延展性好 | 高 | \(\ce{C > SiC > Si}\) 键长:\(\ce{C-C < Si-C < Si-Si}\) |
Gas 气体
Ideal Gas 理想气体
对于理想气体,我们的假设是:
- 理想气体分子间不存在 Intermolecular Forces
- There are no forces of attraction between the gas molecules in ideal gas.
- 理想气体分子不占用任何体积,只有质量(质点)
- Molecules of an ideal gas occupy zero volume.
- 理想气体分子产生的碰撞为弹性碰撞,不损失任何能量
- Gas molecules are in constant motion, colliding with on another and with the walls of their container without losing any energy.
- 理想气体分子间不存在 Intermolecular Forces
对于真实气体,在高温低压下,会越像理想气体
在相同温度和压强下,式量越小,会越像理想气体,比如 \(\ce{H2}, \ce{O2}\),那么 \(\ce{H2}\) 更接近理想气体
Practice:
C

Kinetic Molecular Theory 分子动理论
- 分子动能只与温度有关
- 分子动能和压强无关
- 分子动能和分子种类无关
- Practice:
C

Molecular Kinetic Energy and Speed 分子动能和分子运动速率
- 依据简单的物理理论,我们可以知道动能计算方式如下
\[ k = \frac{1}{2}mv^{2} \]
- 所以,相同温度下分子 $ $与分子 \(\ce{B}\) 的速率之比为他们摩尔质量之比开方的倒数
\[ \frac{v_A}{v_B} = \sqrt{\frac{M_B}{M_A}} \]
- Practice:
\(\ce{O2}\) diffuses in \(8\) seconds. Same temperature and pressure, how long will it take for the same volume of \(\ce{H2}\) to diffuse?
\[ \frac{v_\ce{H_2}}{v_{\ce{O_2}}} = \sqrt{\frac{32}{2}} = 4 \]
So \(\ce{H2}\) needs \(\frac{8}{4} = \pu{2 s}\).
- Practice:
B

- 两边挥发性气体相遇会形成白色沉淀,问 如果要在中间形成沉淀,左右两边分别应该是什么?
- A 选项 \(\ce{HCl}\) 和 \(\ce{CH3NH2}\) 的相对质量最接近,所以速率也最相似
Maxwell-Bolzmann Diagram 麦克斯韦-玻尔兹曼分布
- 左图相同物质,不同温度下,平均分子动能越高,峰值越低(统计学规律,而且分子总量相同)
- 右图不同物质,相同温度,摩尔质量越低,平均分子动能越高
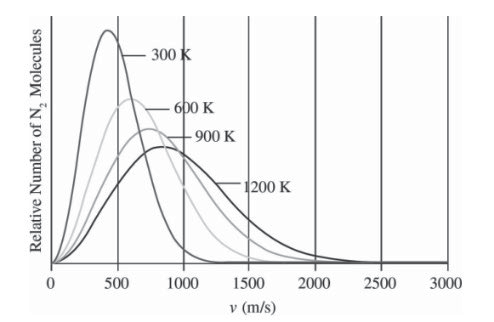
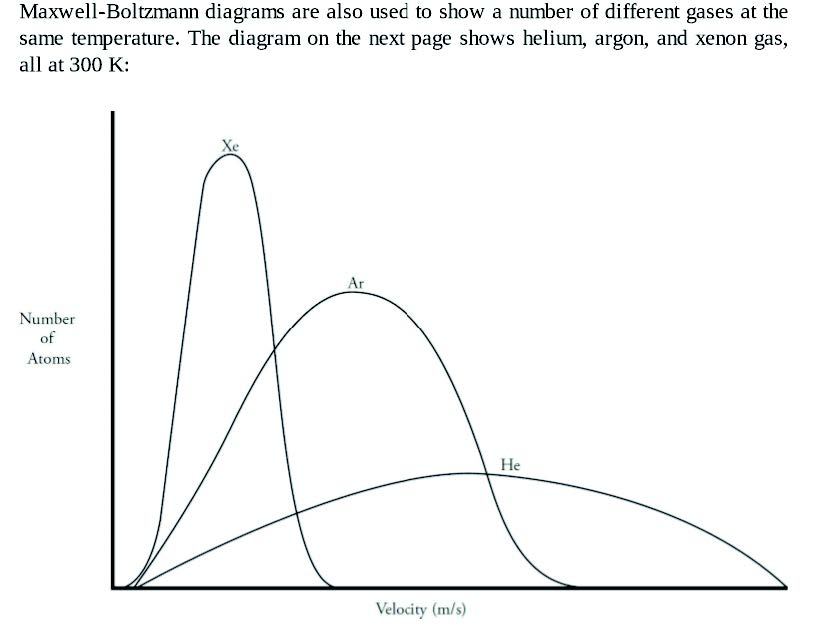
- Practice:
D

Unit of Compression 压强单位
\[ \pu{1 atm} = \pu{760 mmHg} = \pu{760 torr} \]
Equation of Ideal Gas 理想气体方程
\[ pV = nRT \\ \begin{aligned} P &= \text{the pressure of the gas(atm, mmHg, torr)} \\ V &= \text{the volume of the gas(L)} \\ n &= \text{the number of moles of gas(mol)} \\ R &= \text{gas constant} \\ T &= \text{the absolute temperature of the gas(K)} \end{aligned} \]
\[ \begin{aligned} \text{Gas Constant, } R &= \pu{8.314 J mol-1K-1} \\ &= \pu{0.08206 L atm mol-1K-1} \\ &= \pu{62.36 L torr mol-1K-1} \end{aligned} \]
- Charles’s Law (Same Pressure)
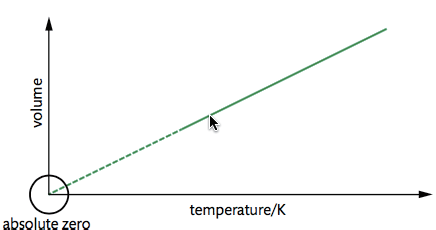
\[ \frac{V_1}{V_2} = \frac{T_1}{T_2} \]
- Boyle’s Law (Same Temperature)

\[ p_1 V_1 = p_2 V_2 \]
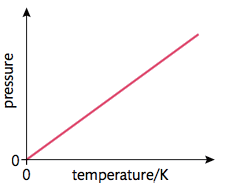
- Gay-Lussac’s Law (Same Volume)
\[ \frac{p_1}{p_2} = \frac{T_1}{T_2} \]
- Avogadro’s Law (Same Temperature and Pressure)
\[ \frac{V_1}{V_2} = \frac{n_1}{n_2} \]


Solution 溶液
Concentration of the Solution
- A solution is a mixture of a solute and a solvent
\[ \begin{aligned} \text{Molarity (M)} &= \frac{\text{Moles of Solute}}{\text{Liters of Solution}} \\ \text{Molality (m)} &= \frac{\text{Moles of Solute}}{\text{Kilograms of Solution}} \end{aligned} \]
- Mole Fraction
\[ \text{Molarity (M)} = \frac{\text{Moles of Solute}}{\text{Moles of Solute} + \text{Moles of Solvent}} \]
